Adenohipófisis y neurohipófisis
La hipófisis denominada también glándula pituitaria, es una pequeña glándula de alrededor de 1 cm de diámetro y 0,5-1 g de peso, situada en la silla turca (una cavidad ósea de la base del cráneo) y unida al hipotálamo mediante el tallo hipofisario. Desde una perspectiva fisiológica, la hipófisis se divide en dos partes bien diferenciadas: el lóbulo anterior o adenohipófisis y el lóbulo posterior o neurohipófisis. Entre estas dos partes existe una pequeña zona poco vascularizada y denominada parte intermedia, mucho menos desarrollada en la especie humana y mucho más grande y funcional en algunos animales.
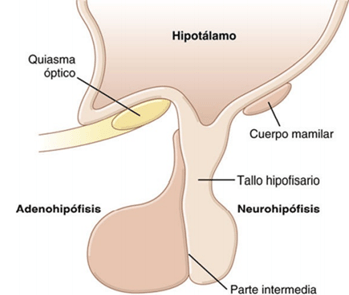
Desde el punto de vista embriológico, las dos porciones de la hipófisis tienen procedencias diferentes: la adenohipófisis deriva de la bolsa de Rathke, una invaginación embrionaria del epitelio faríngeo, y la neurohipófisis lo hace de una evaginación de tejido nervioso del hipotálamo. El origen de la adenohipófisis en el epitelio faríngeo explica la naturaleza epitelial de sus células, mientras que el origen de la neurohipófisis en el tejido nervioso justifica la presencia de abundantes células de tipo glial en esta glándula.
La adenohipófisis secreta seis hormonas peptídicas necesarias y otras de menor importancia, mientras que la neurohipófisis sintetiza dos hormonas peptídicas importantes.
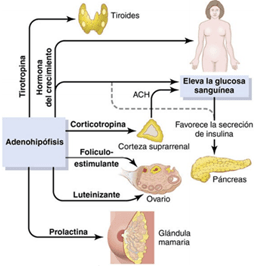
- La hormona del crecimiento estimula el crecimiento de todo el cuerpo mediante su acción sobre la formación de proteínas y sobre la multiplicación y diferenciación celulares.
- La corticotropina controla la secreción de algunas hormonas corticosuprarrenales, que, a su vez, afectan al metabolismo de la glucosa, las proteínas y los lípidos.
- La tirotropina (hormona estimulante del tiroides) controla la secreción de tiroxina y triyodotironina por la glándula tiroides; a su vez, estas hormonas regulan casi todas las reacciones químicas intracelulares que tienen lugar en el organismo.
- La prolactina estimula el desarrollo de las glándulas mamarias y la producción de leche.
- Dos hormonas gonadótropas distintas, la hormona estimulante de los folículos y la hormona luteinizante, controlan el crecimiento de los ovarios y los testículos, así como su actividad hormonal y reproductora.
- Las dos hormonas secretadas por la neurohipófisis desempeñan otras funciones:
- La hormona antidiurética (denominada también vasopresina) controla la excreción de agua en la orina, con lo que ayuda a regular la concentración hídrica en los líquidos corporales.
- La oxitocina contribuye a la secreción de leche desde las glándulas mamarias hasta los pezones durante la lactancia; posiblemente, interviene también en el parto, al final de la gestación.
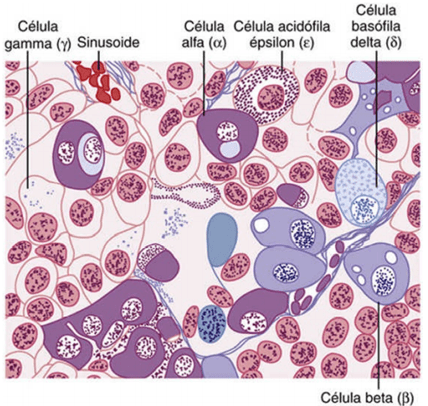
La adenohipófisis contiene diversos tipos celulares que sintetizan y secretan hormonas. Los cinco tipos de células son:
- Somatótropas: hormona del crecimiento humana (GH).
- Corticótropas: corticotropina (ACTH).
- Tirótropas: tirotropina (TSH).
- Gonadótropas: hormonas gonadótropas, es decir, la hormona luteinizante (LH) y la hormona foliculoestimulante (FSH).
- Lactótropas: prolactina (PRL).
El hipotálamo controla la secreción hipofisaria.
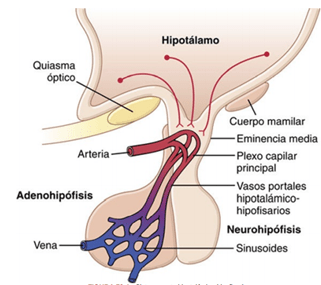
Casi toda la secreción de la hipófisis está controlada por señales hormonales o nerviosas procedentes del hipotálamo. La secreción de la neurohipófisis está controlada por las señales nerviosas que se originan en el hipotálamo y terminan en la neurohipófisis. Por el contrario, la secreción de la adenohipófisis está controlada por hormonas llamadas hormonas (o factores) de liberación y de inhibición hipotalámicas; estas se sintetizan en el propio hipotálamo y pasan a la adenohipófisis. Estas hormonas liberadoras e inhibidoras actúan sobre las células glandulares de la adenohipófisis y rigen su secreción. La adenohipófisis es una glándula muy vascularizada que dispone de amplios senos capilares entre las células glandulares. Casi toda la sangre que penetra en estos senos atraviesa en primer lugar otro lecho capilar del hipotálamo inferior. A continuación, la sangre fluye a través de unos diminutos vasos porta hipotalámico-hipofisarios y accede a los senos adenohipofisarios. El hipotálamo dispone de neuronas especiales que sintetizan y secretan las hormonas liberadoras e inhibidoras hipotalámicas encargadas de controlar la secreción de las hormonas adenohipofisarias. Estas neuronas se originan en diversas partes del hipotálamo y envían sus fibras nerviosas a la eminencia media y al tuber cinereum, una prolongación de tejido hipotalámico en el tallo hipofisario.
La función de las hormonas liberadoras e inhibidoras consiste en controlar la secreción hormonal de la adenohipófisis. En el control de la mayoría de las hormonas adenohipofisarias intervienen sobre todo los factores liberadores, pero en lo que concierne a la prolactina, el mayor control lo ejerce probablemente una hormona hipotalámica inhibidora. Las principales hormonas liberadoras e inhibidoras hipotalámicas son las siguientes:
- Tiroliberina u hormona liberadora de tirotropina (TRH), que induce la liberación de tirotropina.
- Corticoliberina u hormona liberadora de corticotropina (CRH), que produce la liberación de corticotropina.
- Somatoliberina u hormona liberadora de la hormona del crecimiento (GHRH), que produce la liberación de hormona del crecimiento, y hormona inhibidora de la hormona del crecimiento (GHIH), denominada también somatostatina, que inhibe la liberación de la hormona del crecimiento.
- Gonadoliberina u hormona liberadora de las gonadotropinas (GnRH), que produce la liberación de dos hormonas gonadótropas: las hormonas luteinizante (LH) y foliculoestimulante (FSH).
- Hormona inhibidora de la prolactina (PIH), que inhibe la secreción de prolactina.
Funciones fisiológicas de la hormona del crecimiento
La hormona del crecimiento, denominada también hormona somatótropa o somatotropina, es una molécula proteica pequeña que contiene 191 aminoácidos en una sola cadena, con un peso molecular de 22.005. Induce el crecimiento de casi todos los tejidos del organismo que conservan esa capacidad. Favorece el aumento de tamaño de las células y estimula la mitosis, dando lugar a un número creciente de células y a la diferenciación de determinados tipos celulares, como las células del crecimiento óseo y los miocitos precoces. Además de afectar al crecimiento general, la hormona del crecimiento ejerce múltiples efectos metabólicos específicos:
- Aumenta la síntesis proteica en casi todas las células del organismo
- Favorece la movilización de los ácidos grasos del tejido adiposo, incrementa la cantidad de ácidos grasos libres en la sangre y potencia el uso de los ácidos grasos como fuente de energía
- Disminuye la cantidad de glucosa utilizada en todo el organismo.
La hormona del crecimiento favorece el depósito de proteínas en los tejidos
La hormona del crecimiento intensifica el transporte de la mayoría de los aminoácidos a través de las membranas celulares, hacia el interior de la célula. Se eleva así la concentración celular de aminoácidos, lo que parece explicar, al menos en parte, el incremento de la síntesis de proteínas. Este control del transporte de aminoácidos es similar al efecto que ejerce la insulina para controlar el transporte de glucosa a través de la membrana. Aunque la concentración de aminoácidos en las células no aumente, la hormona del crecimiento incrementa la traducción del ARN, haciendo que los ribosomas del citoplasma sinteticen un mayor número de proteínas. En períodos prolongados (de 24 a 48 h), la hormona del crecimiento estimula también la transcripción de ADN en el núcleo, haciendo que aumente la cantidad de ARN formado. A su vez, este proceso intensificará la síntesis de proteínas y el crecimiento, siempre que se disponga de una cantidad suficiente de energía, aminoácidos, vitaminas y otras sustancias necesarias, A largo plazo, esta es quizás la función más importante de la hormona del crecimiento. La hormona del crecimiento mejora casi todos los aspectos de la captación de aminoácidos y de la síntesis proteica por las células y, al mismo tiempo, reduce la degradación de las proteínas.
La hormona del crecimiento favorece la utilización de la grasa como fuente de energía
La hormona del crecimiento induce la liberación de los ácidos grasos del tejido adiposo y, por consiguiente, aumenta su concentración en los líquidos corporales. Asimismo, intensifica la conversión de ácidos grasos en acetil coenzima A (acetil-CoA) y su utilización subsiguiente como fuente de energía en todos los tejidos del organismo. En consecuencia, bajo los efectos de la hormona del crecimiento, los lípidos se usan como fuente de energía, en detrimento de los hidratos de carbono y las proteínas.
La hormona del crecimiento reduce la utilización de los hidratos de carbono
La hormona del crecimiento ejerce múltiples efectos que repercuten en el metabolismo de los hidratos de carbono:
- Disminuye la captación de glucosa en los tejidos como el músculo esquelético y el tejido adiposo
- Aumenta la producción hepática de glucosa
- Incrementa la secreción de insulina.
Cada uno de estos cambios obedece a la resistencia a la insulina inducida por la hormona del crecimiento, que atenúa la acción de la hormona encargada de estimular la captación y la utilización de glucosa por el músculo esquelético y el tejido adiposo y de inhibir la producción hepática de glucosa, todo ello conlleva un incremento de la glucemia y un incremento compensador de la secreción insulínica.
La hormona del crecimiento estimula el crecimiento del cartílago y el hueso

Aunque la hormona del crecimiento estimula el depósito de proteínas y el crecimiento de casi todos los tejidos del organismo, su efecto más evidente consiste en el aumento del crecimiento del esqueleto. Este ocurre como consecuencia de los múltiples efectos que ejerce la hormona del crecimiento sobre el hueso, entre los que destacan:
- aumento del depósito de proteínas por acción de las células condrocíticas y osteógenas inductoras del crecimiento óseo
- la mayor velocidad de reproducción de estas células
- un efecto específico consistente en la conversión de los condrocitos en células osteógenas, con lo que se produce el depósito específico de hueso nuevo.

Existen dos mecanismos fundamentales que explican el crecimiento óseo: por lo que se refiere al primero, en respuesta a la estimulación de la hormona del crecimiento, la longitud de los huesos largos aumenta en los cartílagos epifisarios, donde las epífisis de los extremos del hueso están separadas de las diáfisis. Este crecimiento produce en primer lugar el depósito de cartílago nuevo, seguido de su conversión en hueso nuevo; en consecuencia, las diáfisis se alargan, separándose cada vez más de las epífisis. Al mismo tiempo, el cartílago epifisario va desapareciendo, de modo que al final de la adolescencia ya no queda cartílago epifisario adicional que permita seguir creciendo a los huesos largos. En esas circunstancias tiene lugar la fusión ósea entre la diáfisis y la epífisis en cada uno de los extremos y el crecimiento en longitud de los huesos largos se detiene. En el segundo mecanismo del crecimiento óseo, los osteoblastos del periostio óseo y de algunas cavidades óseas depositan hueso nuevo en la superficie del viejo. Al mismo tiempo, los osteoclastos eliminan el hueso viejo. Cuando el ritmo de aposición supera al de resorción, el grosor del hueso aumenta. La hormona del crecimiento tiene un potente efecto estimulante de los osteoblastos. En consecuencia, el grosor de los huesos puede seguir aumentando durante toda la vida bajo los efectos de la hormona del crecimiento; este es el caso, sobre todo, de los huesos membranosos.
La hormona del crecimiento ejerce muchos de sus efectos a través de sustancias intermedias denominadas somatomedinas
Cuando se aplica directamente hormona de crecimiento a los condrocitos cultivados fuera del organismo, rara vez proliferan o aumentan de tamaño. No obstante, cuando se inyecta al animal intacto, sí induce la proliferación y el crecimiento de esas mismas células. En pocas palabras, la hormona del crecimiento actúa sobre el hígado (y en menor medida sobre otros tejidos) para formar pequeñas proteínas denominadas somatomedinas que, a su vez, ejercen un potente efecto estimulador de todos los aspectos del crecimiento óseo. Muchos de estos efectos de las somatomedinas sobre el crecimiento se asemejan a los de la insulina. Por consiguiente, las somatomedinas reciben también el nombre de factores del crecimiento seudoinsulínicos (IGF). Se han aislado al menos cuatro somatomedinas, pero la más importante de ellas es la somatomedina C (denominada también factor de crecimiento parecido a la insulina I o IGF-I). El peso molecular de la somatomedina C oscila en torno a 7.500 y su concentración plasmática guarda una estrecha correlación con la velocidad de secreción de la hormona del crecimiento. Los pigmeos africanos sufren un defecto congénito que les impide sintetizar cantidades elevadas de somatomedina C. Por consiguiente, aunque presentan una concentración plasmática de hormona del crecimiento normal o elevada, en el plasma se detectan cifras bajas de somatomedina C; parece que este hecho explica la escasa estatura de este pueblo. Otros tipos de enanismo como el enano de Lévi- Lorain también presentan este problema.
Regulación de la secreción de hormona del crecimiento
Después de la adolescencia, la secreción disminuye lentamente con la edad y, en última instancia, alcanza el 25% del nivel de la adolescencia a una edad muy avanzada. La secreción de hormona del crecimiento sigue un patrón pulsátil, con ascensos y descensos. No se conocen los mecanismos exactos que controlan su secreción, pero existen diversos factores relacionados con la nutrición o el estrés que la estimulan:
- la inanición, en especial cuando existe un déficit grave de proteínas
- la hipoglucemia o baja concentración sanguínea de ácidos grasos
- el ejercicio
- la excitación
- los traumatismos
- la grelina, una hormona secretada por el estómago antes de las comidas.
Función del hipotálamo, de la hormona liberadora de la hormona del crecimiento y de la somatostatina en el control de la secreción de hormona del crecimiento
El núcleo hipotalámico que induce la secreción de GHRH (hormona liberadora de la hormona del crecimiento) es el núcleo ventromedial, es decir, la misma región del hipotálamo sensible a la concentración sanguínea de glucosa que provoca la sensación de saciedad en la hiperglucemia y de hambre en la hipoglucemia. La secreción de somatostatina está controlada por otras regiones adyacentes del hipotálamo. Por consiguiente, parece razonable pensar que las mismas señales que modifican el instinto por el que una persona se alimenta también afectan a la tasa de secreción de la hormona del crecimiento. De igual modo, las señales hipotalámicas derivadas de las emociones, el estrés y los traumatismos afectan al control hipotalámico de la secreción de la hormona de crecimiento. De hecho, se ha demostrado de forma experimental que las catecolaminas, la dopamina y la serotonina, cada una liberada por un sistema neuronal hipotalámico distinto, incrementan la secreción de la hormona del crecimiento. Es probable que casi todo el control de la secreción de GH dependa de la GHRH y no de la somatostatina, una hormona inhibidora. La GHRH estimula la secreción de la hormona del crecimiento mediante unión a receptores de membrana específicos en la superficie externa de las células de la GH que se encuentran en la adenohipófisis. A su vez, estos receptores activan al sistema de adenilato ciclasa de la membrana celular, haciendo que la concentración intracelular de monofosfato de adenosina cíclico (AMPc) ascienda. A su vez, este aumento ejerce efectos a corto y largo plazo. El efecto a corto plazo consiste en un incremento del transporte del ion calcio a la célula, que en varios minutos provoca la fusión de las vesículas secretoras de hormona del crecimiento con la membrana celular y la liberación de la hormona hacia la sangre.
Insuficiencia panhipofisaria del adulto
La insuficiencia panhipofisaria que aparece por primera vez en la edad adulta se debe con frecuencia a una de tres anomalías comunes. Dos enfermedades tumorales, los craneofaringiomas o los tumores cromófobos, pueden comprimir la hipófisis hasta producir una destrucción total o prácticamente total de las células adenohipofisarias funcionantes. La tercera causa es la trombosis de los vasos sanguíneos de la hipófisis. Esta anomalía se produce en ocasiones cuando una puérpera sufre un shock circulatorio.
Enanismo
Casi todos los casos de enanismo se deben a una deficiencia generalizada de la secreción de la adenohipófisis (panhipopituitarismo) durante la infancia. En general, todas las partes del organismo se desarrollan de forma proporcionada, pero la velocidad de desarrollo es mucho menor. Los niños de 10 años presentan el desarrollo corporal de uno de 4 o 5 y cuando llegan a los 20 años tienen el desarrollo corporal de un niño de 7 a 10 años. Las personas con enanismo panhipofisario no alcanzan la pubertad y nunca llegan a secretar una cantidad de hormonas gonadótropas suficiente para desarrollar las funciones sexuales de la edad adulta.

Las hormonas del crecimiento varían mucho de una especie animal a otra, por lo que cada una estimula el crecimiento tan solo de una especie o, en todo caso, de especies muy parecidas. Por esta razón, la hormona del crecimiento extraída de animales inferiores (excepto quizá de los primates) no resulta eficaz para los seres humanos. Por consiguiente, la hormona del crecimiento extraída de los seres humanos recibe el nombre de hormona del crecimiento humana para distinguirla de las demás. En el pasado, resultaba muy complicado obtener cantidades suficientes de hormona del crecimiento humana para tratar a los pacientes con déficit de GH, excepto en condiciones experimentales, pues era necesario extraerla de la glándula hipofisaria humana. No obstante, en la actualidad es posible sintetizarla a partir de la bacteria Escherichia coli gracias a la aplicación exitosa de la tecnología del ADN recombinante.
Gigantismo
En ocasiones, las células acidófilas de la glándula adenohipofisaria productoras de hormona del crecimiento se tornan hiperactivas y a veces llegan a originarse tumores acidófilos en la glándula. Como resultado, se sintetizan grandes cantidades de hormona del crecimiento. Todos los tejidos del organismo crecen con rapidez, incluidos los huesos. Si la enfermedad aparece antes de la adolescencia, es decir, antes de que las epífisis de los huesos largos se fusionen a las diáfisis, la persona crecerá hasta convertirse en un gigante de 2,5 m. De ordinario, las personas con gigantismo sufren hiperglucemia y las células β de los islotes de Langerhans del páncreas tienden a degenerar, pues experimentan un proceso de hiperactividad secundario a la hiperglucemia. Por consiguiente, el 10% de las personas con gigantismo desarrollan en algún momento una diabetes mellitus plenamente establecida. Con el tiempo y en ausencia de tratamiento, casi todos los pacientes evolucionan hacia el panhipopituitarismo, pues el gigantismo se debe a menudo a un tumor de la hipófisis que crece hasta destruir la glándula. Este déficit general de hormonas hipofisarias suele causar la muerte al principio de la edad adulta.
Acromegalia
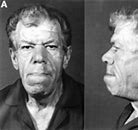
Cuando el tumor acidófilo aparece después de la adolescencia, es decir, cuando las epífisis de los huesos largos se han soldado ya con las diáfisis y todo crecimiento posterior es imposible, los huesos aumentarán de grosor, al igual que los tejidos blandos. Esta enfermedad, ilustrada en la figura 76-8, se denomina acromegalia. El aumento de tamaño es especialmente notable en los huesos de las manos y los pies y en los huesos membranosos, como los del cráneo, la nariz, las protuberancias frontales, los bordes supraorbitarios, el maxilar inferior y porciones de las vértebras, ya que su crecimiento no se interrumpe en la adolescencia. Por tanto, el maxilar inferior se proyecta hacia delante (a veces más de 1 cm) y la frente también se adelanta, por el desarrollo excesivo de los bordes supraorbitarios, el tamaño de la nariz llega a duplicarse, el número de zapato puede llegar o incluso superar el 48 y el grosor de los dedos aumenta en extremo, de forma que las manos alcanzan un tamaño dos veces superior al normal. Además de estos efectos, las lesiones vertebrales provocan la aparición de una joroba, denominada en la clínica cifosis. Por último, muchos tejidos blandos, como la lengua, el hígado y en especial los riñones, aumentan mucho de tamaño.
La neurohipófisis, conocida también como hipófisis posterior o lóbulo posterior de la hipófisis, se compone sobre todo de células similares a las gliales, denominadas pituicitos. Estas células no secretan hormonas, sino que constituyen meras estructuras de sostén para un gran número de fibras nerviosas terminales y de terminaciones nerviosas de las vías procedentes de los núcleos supraóptico y paraventricular del hipotálamo. . Las terminaciones nerviosas son nódulos bulbosos provistos de numerosos gránulos secretores. Estas terminaciones reposan sobre la superficie de los capilares, hacia los que secretan dos hormonas neurohipofisarias: 1) hormona antidiurética (ADH), llamada también vasopresina, y 2) oxitocina.
La ADH se forma principalmente en el núcleo supraóptico, mientras que la oxitocina se forma sobre todo en el paraventricular. Cada uno de estos núcleos puede sintetizar, además de su hormona correspondiente, hasta una sexta parte de la otra. Cuando se transmiten los impulsos nerviosos a lo largo de las fibras desde los núcleos supraóptico o paraventricular, los gránulos secretores de las terminaciones nerviosas liberan de inmediato la hormona, mediante un proceso de secreción habitual conocido como exocitosis, y aquella penetra en los capilares adyacentes. La neurofisina y la hormona del crecimiento se secretan a la vez, pero dado que su unión es laxa, la hormona se separa con gran rapidez.
La inyección de cantidades minúsculas de ADH (de tan solo 2 ng) reduce la excreción renal de agua. Si no existe ADH, los túbulos y conductos colectores serán prácticamente impermeables al agua, lo que evitará su reabsorción e inducirá una pérdida extrema de líquido en la orina, que estará muy diluida. Por el contrario, en presencia de ADH, aumenta en gran medida la permeabilidad de los conductos y túbulos colectores, por lo que casi toda el agua se reabsorbe a medida que el líquido tubular atraviesa estos conductos, haciendo que el organismo conserve el agua y produzca una orina muy concentrada. Sin la hormona, las membranas luminales de las células epiteliales de los túbulos son prácticamente impermeables al agua. No obstante, en el interior de la membrana celular existe un gran número de vesículas especiales que contienen poros muy permeables al agua denominados acuaporinas. Cuando la ADH actúa en la célula, se combina primero con los receptores de membrana que activan a la adenilato ciclasa e inducen la formación de AMPc en el citoplasma de las células tubulares. Esta formación, a su vez, provoca la fosforilación de los elementos contenidos en las vesículas especiales, lo que determina la inserción de dichas vesículas en las membranas celulares apicales y proporciona así numerosas zonas muy permeables al agua. Todo este proceso dura entre 5 y 10 min. Después, en ausencia de ADH, todo el proceso se invierte en otros 5 a 10 min.
Funciones fisiológicas de la oxitocina
La hormona oxitocina estimula con fuerza la contracción del útero en el embarazo, en especial al final de la gestación. Por consiguiente, muchos tocólogos piensan que esta hormona es la responsable, al menos en parte, de la inducción del parto. Esta opinión está respaldada por los siguientes hechos:
- Cuando se secciona la hipófisis de la hembra preñada, la duración del período de dilatación aumenta mucho, lo que indica un posible efecto de la oxitocina durante el parto
- la concentración plasmática de oxitocina asciende durante el parto, en especial en la última fase, la estimulación del cuello uterino de la hembra preñada desencadena señales nerviosas que pasan al hipotálamo e incrementan la secreción de oxitocina.
La oxitocina también desempeña una función esencial en la lactancia; se conocen más detalles acerca de esta función que de la relacionada con el nacimiento. Durante la lactancia, induce la expresión de leche desde los alvéolos hasta los conductos mamarios, de forma que el hijo pueda extraerla mamando. El mecanismo es el siguiente: el estímulo de succión en el pezón mamario desencadena la transmisión de señales a través de nervios sensitivos a las neuronas secretoras de oxitocina de los núcleos paraventricular y supraóptico del hipotálamo, haciendo que la neurohipófisis libere la hormona. A continuación, la oxitocina llega por la sangre hasta las mamas, donde induce la contracción de las células mioepiteliales que rodean y forman un entramado alrededor de los alvéolos de las glándulas mamarias. Menos de 1 min después de comenzar la succión, comienza a fluir la leche.