
La glándula tiroides, situada justo por debajo de la laringe y a ambos lados y por delante de la tráquea, es una de las glándulas endocrinas más grandes, con un peso que oscila entre 15 y 20 g en los adultos sanos. El tiroides secreta dos hormonas importantes, la tiroxina y la triyodotironina, conocidas a menudo como T4 y T3, respectivamente. Ambas inducen un notable aumento del metabolismo del organismo. La ausencia completa de secreción tiroidea provoca con frecuencia descensos metabólicos de hasta un 40-50% inferiores al valor normal, mientras que la secreción excesiva incrementa el metabolismo en hasta el 60-100% por encima de lo normal. La secreción tiroidea está controlada por la tirotropina (TSH), secretada por la adenohipófisis.
Síntesis y secreción de las hormonas metabólicas tiroideas
Alrededor del 93% de las hormonas con actividad metabólica secretadas por la glándula tiroides corresponde a tiroxina y el 7% restante, a triyodotironina. No obstante, con el tiempo, casi toda la tiroxina se convierte en triyodotironina en los tejidos, por lo que ambas desempeñan funciones importantes. Estas funciones son cualitativamente similares, aunque difieren en la rapidez y la intensidad de la acción. La triyodotironina es unas cuatro veces más potente que la tiroxina, si bien se detecta una cantidad mucho menor en la sangre y su duración es más breve.
Anatomía fisiológica de la glándula tiroides

La glándula tiroides se compone de un elevado número de folículos cerrados (100 a 300 μm de diámetro), que están repletos de una sustancia secretora denominada coloide y revestidos por células epiteliales cúbicas que secretan a la luz de los folículos. El componente principal del coloide es una glucoproteína de gran tamaño, la tiroglobulina, cuya molécula contiene las hormonas tiroideas. Cuando la secreción se encuentra en los folículos, la sangre debe absorberla de nuevo a través del epitelio folicular para que pueda actuar en el organismo.
Para formar una cantidad normal de tiroxina se precisan al año unos 50 mg de yodo (ingerido en forma de yoduros) o el equivalente a 1 mg/semana. Para impedir la deficiencia de yodo, se añade una parte de yoduro sódico por cada 100.000 partes de cloruro sódico a la sal de mesa común. Los yoduros ingeridos por vía oral se absorben desde el tubo digestivo hasta la sangre de la misma forma que los cloruros. En condiciones normales, la mayor parte se excreta con rapidez por vía renal, pero siempre después de que las células tiroideas hayan retirado selectivamente una quinta parte de la sangre circulante y la hayan empleado en la síntesis de las hormonas tiroideas.

Bomba de yoduro: el simportador del yoduro de sodio (atrapamiento de yoduro) La primera etapa de la formación de las hormonas tiroideas consiste en el transporte de los yoduros desde la sangre hasta las células y los folículos de la glándula tiroides. La membrana basal de estas células posee la capacidad específica de bombear de forma activa el yoduro al interior celular. Este bombeo se consigue mediante la acción de un simportador del yoduro de sodio, que cotransporta el ion yoduro a lo largo de dos iones sodio a través de la membrana basolateral (plasma) a la célula. La energía para el transporte del yoduro en contra de un gradiente de concentración proviene de la bomba de sodio-potasio-adenosina trifosfatasa (ATPasa), que bombea sodio al exterior de la célula, con lo que establece una baja concentración de sodio intracelular y un gradiente para facilitar la difusión de sodio en la célula.
En una glándula normal, la bomba de yoduro concentra esta sustancia hasta que su concentración supera en 30 veces la de la sangre. Cuando la glándula tiroides alcanza su máxima actividad, la relación entre ambas concentraciones puede elevarse hasta 250 veces. El atrapamiento de yoduro por la glándula tiroides depende de diversos factores, el más importante de los cuales es la concentración de TSH; esta hormona estimula la actividad de la bomba de yoduro en las células tiroideas, mientras que la hipofisectomía la disminuye. El yoduro es transportado fuera de las células tiroideas a través de la membrana apical hacia el folículo por una molécula de contratransporte de cloruro-yoduro denominada pendrina.
Tiroglobulina y química de la formación de tiroxina y triyodotironina.
Formación y secreción de tiroglobulina por las células tiroideas Las células tiroideas constituyen un ejemplo típico de células glandulares secretoras de proteínas. El retículo endoplásmico y el aparato de Golgi sintetizan y secretan hacia los folículos una gran molécula glucoproteica denominada tiroglobulina, con un peso molecular aproximado de 335.000. Cada molécula de tiroglobulina contiene unas 70 moléculas del aminoácido tirosina, que es el sustrato principal que se combina con el yodo para dar lugar a las hormonas tiroideas. Así pues, las hormonas tiroideas se forman dentro de la molécula de tiroglobulina.
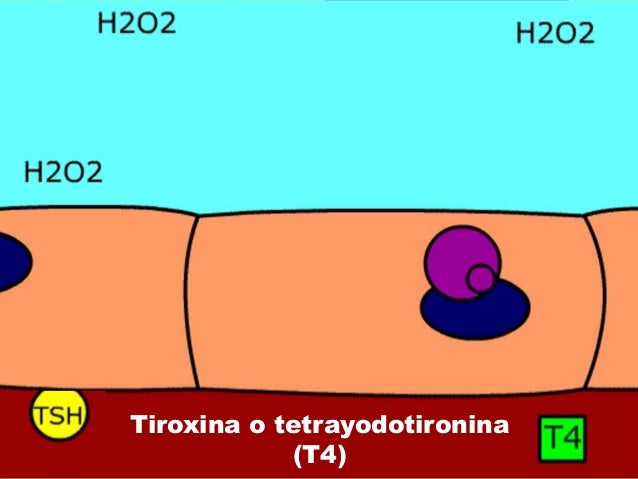
El primer paso crítico para la formación de las hormonas tiroideas consiste en la conversión de los iones yoduro en una forma oxidada del yodo, bien en yodo naciente (I 0 ), bien en I 3 – , que luego puede combinarse directamente con el aminoácido tirosina. La oxidación del yodo depende de la enzima peroxidasa y su peróxido de hidrógeno acompañante, que constituyen un potente sistema capaz de oxidar los yoduros. La peroxidasa se encuentra en la membrana apical de la célula o unida a ella, proporcionando así el yodo oxidado justo en el lugar de la célula donde la molécula de tiroglobulina abandona el aparato de Golgi y atraviesa la membrana celular hasta el coloide almacenado en la glándula tiroides. Cuando el sistema de la peroxidasa se bloquea o en los casos de ausencia congénita, la velocidad de formación de hormonas tiroideas disminuye hasta cero.
Yodación de la tirosina y formación de las hormonas tiroideas: «organificación» de la tiroglobulina La unión del yodo a la molécula de tiroglobulina recibe el nombre de organificación de la tiroglobulina. El yodo oxidado (incluso en forma molecular) se une directamente, aunque con lentitud, al aminoácido tirosina. No obstante, en las células tiroideas el yodo oxidado se asocia a la enzima tiroidea peroxidasa, que hace que el proceso tenga lugar en segundos o minutos. Por consiguiente, a medida que la tiroglobulina se libera del aparato de Golgi o se secreta al folículo a través de la membrana apical de la célula, el yodo se fija a alrededor de la sexta parte de las tirosinas contenidas en la molécula de tiroglobulina.
El principal producto hormonal de la reacción de acoplamiento es la molécula tiroxina (T4), que se forma cuando se unen dos moléculas de diyodotirosina; la tirosina forma parte aún de la molécula de tiroglobulina. En otras ocasiones, una molécula de monoyodotirosina se une con una de diyodotirosina para formar triyodotironina (T3), que representa alrededor de la quinceava parte del total final de hormonas. Se forman pequeñas cantidades de T3 inversa (RT3) mediante acoplamiento de diyodotirosina con monoyodotirosina, aunque la RT3 no parece tener importancia funcional en los seres humanos. Almacenamiento de la tiroglobulina La glándula tiroides es la única glándula endocrina que posee la capacidad de almacenar grandes cantidades de hormona. Una vez finalizada la síntesis de las hormonas tiroideas, cada molécula de tiroglobulina contiene hasta 30 moléculas de tiroxina y algunas de triyodotironina.
Liberación de tiroxina y triyodotironina del tiroides
La mayor parte de la tiroglobulina no se libera a la sangre circulante, sino que es preciso que la tiroxina y triyodotironina se escindan de la molécula de tiroglobulina; a continuación, ambas se secretan en forma libre. Este proceso tiene lugar por el siguiente mecanismo: la superficie apical de las células tiroideas emite extensiones en forma de seudópodos que rodean a pequeñas porciones del coloide, constituyendo vesículas de pinocitosis, que alcanzan la punta de la célula tiroidea. A continuación, los lisosomas del citoplasma celular se funden de inmediato con estas vesículas y forman otras vesículas digestivas que contienen enzimas procedentes de los lisosomas mezcladas con el coloide. Varias enzimas proteinasas digieren las moléculas de tiroglobulina, y liberan la tiroxina y la triyodotironina, que se difunden entonces a través de la base de la célula tiroidea, hacia los capilares circundantes, y de este modo pasan a la sangre. Parte de la tiroglobulina del coloide entra en la célula tiroidea por endocitosis después de su unión a la megalina, una proteína situada en la membrana luminal de las células. A continuación, el complejo megalina-tiroglobulina es transportado a través de la célula por transcitosis hasta la membrana basolateral, donde una parte de la megalina permanece unida a la tiroglobulina y es liberada en la sangre capilar. Alrededor de las tres cuartas partes de la tirosina yodada en la tiroglobulina nunca se convierten en hormona tiroidea, sino que permanecen como monoyodotirosina y diyodotirosina.
Transporte de tiroxina y triyodotironina a los tejidos La tiroxina y la triyodotironina están unidas a proteínas plasmáticas Cuando acceden a la sangre, más del 99% de la tiroxina y la triyodotironina se combina de inmediato con diversas proteínas plasmáticas, todas ellas sintetizadas por el hígado. Estas proteínas son, ante todo, la globulina fijadora de la tiroxina y, en menor medida, la prealbúmina y la albúmina fijadora de la tiroxina. La tiroxina y la triyodotironina se liberan lentamente a las células de los tejidos Debido a la gran afinidad de las proteínas de unión plasmáticas por las hormonas tiroideas, estas sustancias, en concreto la tiroxina, se liberan con lentitud a las células de los tejidos. La mitad de la tiroxina presente en la sangre se libera a las células de los tejidos cada 6 días aproximadamente, mientras que la mitad de la triyodotironina, dada su menor afinidad, tarda 1 día en llegar a las células.
Funciones fisiológicas de las hormonas tiroideas
Las hormonas tiroideas aumentan la transcripción de una gran cantidad de genes El efecto general de las hormonas tiroideas consiste en la activación de la transcripción nuclear de un gran número de genes. Por consiguiente, en casi todas las células del organismo se sintetiza una elevada proporción de enzimas proteicas, proteínas estructurales, proteínas transportadoras y otras sustancias. El resultado neto es un aumento generalizado de la actividad funcional de todo el organismo. Antes de actuar sobre los genes e incrementar la transcripción genética, gran parte de la tiroxina liberada pierde un yoduro y se forma triyodotironina. Los receptores intracelulares de hormona tiroidea poseen una gran afinidad por la triyodotironina. Por consiguiente, alrededor del 90% de las moléculas de hormona tiroidea que se unen a los receptores es triyodotironina.
Los receptores de hormona tiroidea se encuentran unidos a las cadenas genéticas de ADN o junto a ellas. El receptor suele formar un heterodímero con el receptor retinoide X (RXR) en los elementos específicos de respuesta a la hormona tiroidea del ADN. Después de unirse a esta hormona, los receptores se activan e inician el proceso de transcripción. A continuación, se forma una cantidad elevada de ARN mensajero de distintos tipos, seguido en unos minutos u horas de la traducción del ARN en los ribosomas citoplásmicos, para formar cientos de proteínas intracelulares nuevas. No obstante, no todas las proteínas aumentan en un porcentaje similar; algunas lo hacen solo en escasa medida y otras llegan a incrementarse hasta seis veces. Se cree que casi todas las acciones de la hormona tiroidea son consecuencia de las funciones enzimáticas y de otros tipos de acciones de estas nuevas proteínas.
Las hormonas tiroideas incrementan las actividades metabólicas de casi todos los tejidos del organismo. El metabolismo basal se incrementa entre el 60 y el 100% por encima de su valor normal cuando las concentraciones hormonales son altas. La velocidad de utilización de los alimentos como fuente de energía se encuentra muy acelerada. Aunque la síntesis de proteínas aumenta, también lo hace el catabolismo proteico. La velocidad de crecimiento de las personas jóvenes experimenta una gran aceleración. Los procesos mentales se estimulan y las actividades de las demás glándulas endocrinas se potencian. Una de las enzimas que aumentan en respuesta a la hormona tiroidea es la Na + -K + -ATPasa; a su vez, este aumento de la actividad potencia el transporte de los iones sodio y potasio a través de la membrana celular de determinados tejidos. Este proceso requiere energía e incrementa la cantidad de calor producida por el organismo, por lo que se ha propuesto que quizá constituya uno de los mecanismos mediante los cuales la hormona tiroidea eleva el metabolismo.
La hormona tiroidea ejerce efectos generales y específicos sobre el crecimiento. Por ejemplo, se sabe desde hace bastante tiempo que la hormona tiroidea es esencial para la metamorfosis del renacuajo en rana. En la especie humana, el efecto de la hormona tiroidea sobre el crecimiento se manifiesta sobre todo en los niños en edad de desarrollo. En los niños hipotiroideos, la velocidad de crecimiento es mucho más lenta, mientras que los hipertiroideos a menudo experimentan un crecimiento esquelético excesivo, por lo que son bastante más altos de lo que les correspondería según su edad. No obstante, los huesos también maduran con mayor rapidez y las epífisis se cierran a una edad temprana, por lo que el crecimiento resulta más breve y la estatura final en la edad adulta puede ser, en realidad, menor.
Efectos de las hormonas tiroideas sobre funciones corporales específicas
Estimulación del metabolismo de los hidratos de carbono La hormona tiroidea estimula casi todas las fases del metabolismo de los hidratos de carbono, entre ellos, la rápida captación de glucosa por las células, el aumento de la glucólisis, el incremento de la gluconeogenia, una mayor absorción en el tubo digestivo e incluso una mayor secreción de insulina, con sus efectos secundarios sobre el metabolismo de los hidratos de carbono. Estimulación del metabolismo de los lípidos La hormona tiroidea también potencia casi todos los aspectos del metabolismo de los lípidos. En concreto, los lípidos se movilizan con rapidez del tejido adiposo, lo que disminuye los depósitos de grasas del organismo en mayor medida que en casi todos los demás tejidos. Efecto sobre los lípidos plasmáticos y hepáticos El incremento de hormona tiroidea induce un descenso de la concentración plasmática de colesterol, fosfolípidos y triglicéridos, aunque eleva los ácidos grasos libres. Por el contrario, la disminución de la secreción tiroidea aumenta en gran medida la concentración plasmática de colesterol, fosfolípidos y triglicéridos y casi siempre origina un depósito excesivo de lípidos en el hígado. El gran aumento del colesterol plasmático circulante observado en el hipotiroidismo prolongado se asocia a menudo a una arterioesclerosis grave.
Mayor necesidad de vitaminas: dado que la hormona tiroidea incrementa la cantidad de numerosas enzimas corporales y que las vitaminas suponen una parte esencial de algunas enzimas o coenzimas, la hormona tiroidea aumenta las necesidades de vitaminas. Por consiguiente, a veces aparece un déficit vitamínico cuando se secreta una cantidad excesiva de hormona tiroidea, salvo que el organismo disponga al mismo tiempo de mayor cantidad de vitaminas
Aumento del metabolismo basal: la hormona tiroidea aumenta el metabolismo de casi todas las células del organismo, por lo que, en cantidades excesivas, tiende a elevar el metabolismo basal hasta un 60 a un 100% por encima de las cifras normales. Por el contrario, cuando no se produce hormona tiroidea, el metabolismo basal disminuye hasta la mitad de lo normal.

Disminución del peso corporal: los grandes aumentos de la concentración de hormona tiroidea casi siempre producen adelgazamiento, mientras que su disminución marcada se asocia en la mayoría de los casos a una ganancia ponderal; sin embargo, no siempre se producen estos efectos, ya que la hormona tiroidea también incrementa el apetito, lo que compensa el cambio metabólico.
Aumento del flujo sanguíneo y del gasto cardíaco: el aumento del metabolismo en los tejidos acelera la utilización de oxígeno e induce la liberación de cantidades excesivas de productos metabólicos finales a partir de los tejidos. Estos efectos dilatan los vasos de casi todos los tejidos orgánicos, elevando así el flujo sanguíneo. La elevación es más acusada en la piel, debido a la mayor necesidad de eliminar el calor del organismo. Como consecuencia del mayor flujo sanguíneo, aumenta también el gasto cardíaco, que en ocasiones se eleva al 60% o más por encima de sus valores normales cuando existe una cantidad excesiva de hormona tiroidea.

Aumento de la frecuencia cardíaca: bajo la influencia de la hormona tiroidea, la frecuencia cardíaca se eleva mucho más de lo que cabría esperar por el incremento del gasto cardíaco. Por consiguiente, parece que la hormona tiroidea ejerce un efecto directo sobre la excitabilidad del corazón, que a su vez aumenta la frecuencia cardíaca. Este efecto tiene especial importancia, ya que la frecuencia cardíaca es uno de los signos físicos en los que se basa el médico para determinar si un paciente produce una cantidad excesiva o insuficiente de hormona tiroidea.
Aumento de la fuerza cardíaca: la mayor actividad enzimática inducida por la producción elevada de hormona tiroidea aumenta la fuerza del corazón cuando se secreta un ligero exceso de hormona tiroidea. Este efecto es análogo al incremento de la fuerza cardíaca que tiene lugar en presencia de febrícula y durante el ejercicio. No obstante, cuando la concentración de hormona tiroidea asciende de forma notable, la potencia del músculo cardíaco se deprime, debido a un catabolismo proteico excesivo y prolongado.
Presión arterial normal La presión arterial media suele permanecer dentro de los valores normales tras la administración de hormona tiroidea. No obstante, debido al aumento del flujo sanguíneo del tejido entre los latidos cardíacos, la presión diferencial tiende a elevarse; en el hipertiroidismo se observa un ascenso de la presión sistólica de 10-15 mmHg y una reducción similar de la presión diastólica.
Efecto sobre la función muscular: Un ligero incremento de la hormona tiroidea desencadena una reacción muscular enérgica, pero cuando la cantidad de hormona resulta excesiva, los músculos se debilitan a causa del catabolismo excesivo de las proteínas. En cambio, la carencia de hormona tiroidea reduce la actividad de los músculos, que se relajan lentamente tras la contracción.
Temblor muscular: Uno de los signos más característicos del hipertiroidismo consiste en un ligero temblor muscular. Este síntoma no es comparable al temblor ostensible que se observa en la enfermedad de Parkinson o en los escalofríos, ya que su frecuencia es rápida, de 10 a 15 veces por segundo. El temblor se percibe con facilidad colocando una hoja de papel sobre los dedos extendidos y observando el grado de vibración del papel. Este temblor se atribuye a un aumento de la reactividad de las sinapsis neuronales en las regiones de la médula espinal que controlan el tono muscular.

Efecto sobre el sueño: La hormona tiroidea ejerce un efecto agotador sobre la musculatura y sobre el sistema nervioso central, por lo que las personas con hipertiroidismo suelen sentirse siempre cansadas, aunque les resulte difícil conciliar el sueño debido a sus efectos excitantes sobre las sinapsis. Por el contrario, el hipotiroidismo se caracteriza por una somnolencia extrema y el sueño se prolonga a veces entre 12 y 14 h diarias.
El aumento de la concentración de hormona tiroidea eleva la secreción de casi todas las demás glándulas endocrinas, aunque también la necesidad tisular de hormonas. Por ejemplo, cuando se incrementa la secreción de tiroxina, lo hace también el metabolismo de la glucosa de casi todo el organismo, lo que se asocia a una mayor necesidad de secreción de insulina por el páncreas. Asimismo, la hormona tiroidea potencia muchas actividades metabólicas relacionadas con la formación del hueso y, como consecuencia, eleva las necesidades de hormona paratiroidea. Por último, la hormona tiroidea incrementa la velocidad de desactivación hepática de los glucocorticoides suprarrenales.
Efecto de las hormonas tiroideas sobre la función sexual
Para que la función sexual sea normal, la secreción tiroidea ha de aproximarse a la normalidad. En lo que se refiere a los varones, la carencia de hormona tiroidea provoca a menudo pérdida de la libido, mientras que su concentración excesiva causa a veces impotencia. En cuanto a las mujeres, la falta de hormona tiroidea produce a menudo menorragia, y polimenorrea, es decir, una hemorragia menstrual excesiva y frecuente, respectivamente. Sin embargo, y aunque parezca extraño, en determinados casos la ausencia de hormona tiroidea induce menstruaciones irregulares y en ocasiones amenorrea (ausencia de hemorragia menstrual). Es probable que las mujeres con hipotiroidismo, al igual que los varones, sufran una importante disminución de la libido. Un aspecto que complica aún más el cuadro en las mujeres hipotiroideas es la oligomenorrea (hemorragia menstrual muy escasa) y, en ocasiones, la amenorrea. La acción de la hormona tiroidea sobre las gónadas no puede circunscribirse a una función específica, sino que obedece a la combinación de diversos efectos metabólicos directos sobre las gónadas y a ciertos efectos de retroalimentación (excitadores e inhibidores) que operan a través de las hormonas adenohipofisarias que controlan las funciones sexuales.
La TSH, denominada también tirotropina, es una hormona adenohipofisaria, una glucoproteína con un peso molecular de aproximadamente 28.000. Los efectos que ejerce sobre la glándula tiroides son los siguientes:
- Eleva la proteólisis de la tiroglobulina que se encuentra almacenada en los folículos, con lo que se liberan hormonas tiroideas a la sangre circulante y disminuye la sustancia folicular.
- Incrementa la actividad de la bomba de yoduro, que favorece el «atrapamiento del yoduro» por las células glandulares, elevando en ocasiones la relación entre las concentraciones intra- y extracelular de yodo en la sustancia glandular hasta ocho veces por encima de los valores normales.
- Intensifica la yodación de la tirosina para formar hormonas tiroideas.
- Aumenta el tamaño y la actividad secretora de las células tiroideas.
- Incrementa el número de células tiroideas y transforma las células cúbicas en cilíndricas e induce el plegamiento del epitelio tiroideo en el interior de los folículos.
La secreción de TSH por la adenohipófisis está controlada por una hormona hipotalámica, la tiroliberina u hormona liberadora de tirotropina (TRH), secretada por las terminaciones nerviosas de la eminencia media del hipotálamo. La TRH es una amida tripeptídica: piroglutamil-histidil-prolina-amida. La TRH actúa directamente sobre las células de la adenohipófisis, incrementando su producción de TSH. Cuando se bloquea el sistema porta que conecta el hipotálamo con la adenohipófisis, la secreción adenohipofisaria de TSH experimenta un gran descenso, aunque no llega a desaparecer. El mecanismo molecular mediante el cual la TRH estimula a las células adenohipofisarias secretoras de TSH para que sinteticen esta hormona consiste, en primer lugar, en su unión a los receptores de TRH de la membrana celular de la hipófisis.

Efecto de retroalimentación de las hormonas tiroideas para disminuir la secreción adenohipofisaria de TSH El ascenso de la concentración de hormona tiroidea en los líquidos corporales reduce la secreción de TSH por la adenohipófisis, Cuando la secreción de hormona tiroidea aumenta hasta 1,75 veces los valores normales, la secreción de TSH cae hasta casi desaparecer. Este efecto depresor mediante retroalimentación apenas disminuye cuando se separa la adenohipófisis del hipotálamo. Por consiguiente, parece probable que la elevación de la hormona tiroidea inhiba la secreción adenohipofisaria de TSH principalmente por un efecto directo sobre la propia adenohipófisis. Cualquiera que sea el mecanismo de la retroalimentación, su efecto consiste en mantener una concentración prácticamente constante de hormona tiroidea libre en los líquidos corporales circulantes.
Enfermedades del tiroides
Hipertiroidismo
En la mayoría de los pacientes con hipertiroidismo se observa un aumento de tamaño de la glándula tiroides, que llega a duplicarse o triplicarse, con una hiperplasia considerable y un plegamiento del revestimiento de las células foliculares en los folículos, por lo que el número de células también aumenta de forma notable. Además, la secreción de cada célula se multiplica varias veces; los estudios sobre la captación de yodo radiactivo indican que estas glándulas hiperplásicas secretan en ocasiones cantidades de hormona tiroidea superiores en 5 a 15 veces su valor normal. La enfermedad de Graves, la forma más común de hipertiroidismo, es una enfermedad autoinmunitaria en la que se forman unos anticuerpos denominados inmunoglobulinas tiroestimulantes (TSI) contra el receptor de TSH. Estos anticuerpos se unen a los mismos receptores de membrana que la TSH e inducen una activación continua del sistema AMPc de las células que se traduce en la aparición de hipertiroidismo. Los anticuerpos TSI inducen un efecto estimulante prolongado sobre la glándula tiroides que dura hasta 12 h y contrasta con la brevedad de la acción de la TSH, que es solo de 1 h. La elevada secreción de hormona tiroidea causada por la TSI suprime, a su vez, la formación adenohipofisaria de TSH. Por tanto, las concentraciones de TSH son menores de lo normal (a menudo, esencialmente nulas), y no aparecen elevadas, en la mayoría de los pacientes con enfermedad de Graves. Los anticuerpos causantes del hipertiroidismo aparecen como resultado de la autoinmunidad desarrollada frente al tejido tiroideo. Parece probable que en algún momento de la vida de la persona, las células tiroideas hayan liberado una cantidad excesiva de antígenos y que este efecto se haya traducido en la formación de anticuerpos contra la glándula.
Los síntomas de hipertiroidismo deben resultar evidentes a partir de la exposición anterior de la fisiología de las hormonas tiroideas:
- estado de gran excitabilidad
- intolerancia al calor
- aumento de la sudoración
- adelgazamiento leve o extremo
- grado variable de diarrea
- debilidad muscular
- nerviosismo u otros trastornos psíquicos
- fatiga extrema e incapacidad para conciliar el sueño
- temblor de las manos.
Hipotiroidismo
Por lo general, los efectos del hipotiroidismo son opuestos a los del hipertiroidismo, pero comprende también algunos mecanismos fisiológicos peculiares. El hipotiroidismo, al igual que el hipertiroidismo, a menudo se inicia por autoinmunidad contra la glándula tiroides (enfermedad de Hashimoto), aunque en este caso la inmunidad no estimula a la glándula, sino que la destruye. En primer lugar, la glándula tiroides de casi todos estos pacientes sufre una tiroiditis autoinmunitaria, es decir, una inflamación del tiroides, que provoca su deterioro progresivo y, en última instancia, la fibrosis de la glándula, con una secreción escasa o nula de hormonas tiroideas.
Cretinismo

El cretinismo se debe a un hipotiroidismo extremo sufrido durante la vida fetal, la lactancia o la infancia. Esta enfermedad se caracteriza especialmente por la falta de crecimiento y por retraso mental. Puede deberse a la ausencia congénita de la glándula tiroides (cretinismo congénito), a que la glándula tiroides no sintetiza hormona tiroidea por un defecto genético de la glándula o una carencia de yodo en la alimentación (cretinismo endémico). Algunos neonatos que carecen de glándula tiroides tienen un aspecto y una función normales, ya que recibieron cierta cantidad (aunque no suficiente) de hormona tiroidea de la madre durante la vida uterina; no obstante, varias semanas después de nacer, los movimientos del niño se hacen más lentos y el crecimiento físico y mental se retrasa considerablemente. El tratamiento de los recién nacidos con cretinismo, basado en la administración en cualquier momento de una cantidad adecuada de yodo o de tiroxina, normaliza el crecimiento físico, pero si esta enfermedad no se trata pocas semanas después del parto, el crecimiento mental sufrirá un retraso permanente. Este estado se explica por el retraso del crecimiento, la ramificación y la mielinización de las células neuronales del sistema nervioso central en ese período crítico para el desarrollo de las aptitudes mentales.